Durante el verano de 2003 una inesperada ola de calor azotó toda Europa, llevándose por delante la vida de miles de ciudadanos. En Alicante hacía calor también, como siempre. Pero esas altas temperaturas no parecieron afectar al trabajo de un investigador de la universidad, un microbiólogo que llevaba ya diez años tratando de entender un curioso patrón de secuencias de ADN que había encontrado en 1993 en el genoma de un microorganismo habitante de las salinas de Santa Pola, una arquea llamada Haloferax mediterranei. No era el primero en reportar esos patrones, unos científicos japoneses los habían descrito ya en 1987 en el genoma de la más famosa de las bacterias: Escherichia coli. Pero ellos no continuaron investigando ese tema. Por el contrario, el microbiólogo alicantino quedó prendado de aquellos patrones de secuencias y continuó estudiándolos. Tanto le interesaron que incluso decidió ponerles, a finales de 2001, un nombre: CRISPR, siglas en inglés del acrónimo “Repeticiones Palindrómicas Cortas Agrupadas y Regularmente Espaciadas” que describía fielmente esas secuencias.
Aquel científico era Francisco Juan Martínez Mojica —conocido por todos sus amigos y colegas de profesión como Francis Mojica— y en 2003 llevaba diez años enfrascado en comprender por qué muchas bacterias se empecinaban en intercalar secuencias de ADN desconocido flanqueadas por otras que siempre eran las mismas, secuencias repetidas cuya función seguía siendo un misterio.
En 2003 Francis encontró nada menos que un sistema de defensa propio de las bacterias que aprendía añadiendo nuevos fragmentos de nuevos virus ante los cuales aquellas bacterias se tornaban resistentes
Y fue precisamente durante ese tórrido verano de 2003 cuando Francis tuvo su momento eureka, cuando se dio cuenta de algo que nadie más en el mundo había comprendido hasta entonces. Al analizar las secuencias CRISPR del genoma de muchas bacterias se percató que algunas de esos fragmentos de ADN desconocido eran en realidad trozos del genoma de virus que infectaban a bacterias, llamados bacteriófagos. A lo que añadió una observación no menos sorprendente: cuando una bacteria portaba el fragmento del genoma de un determinado virus en su agrupación CRISPR, esa bacteria era resistente a la infección por ese mismo virus. Blanco y en botella: Francis había encontrado nada menos que un sistema de defensa propio de las bacterias, un sistema inmunitario de base genética y adaptativo, que aprendía añadiendo nuevos fragmentos de nuevos virus ante los cuales aquellas bacterias se tornaban resistentes.
Francis no pudo publicar estos hallazgos hasta 2005, tras batallar infructuosamente con las grandes revistas, que, una tras otra, no le creyeron y desdeñaron esa observación, sin entender su relevancia. Finalmente, el trabajo se publicó en la revista Journal of Molecular Evolution, digna pero modesta. Los buenos trabajos de investigación, los que aportan nuevos conocimientos, siempre acaban saliendo a flote, sin importar el medio en el que se publiquen.
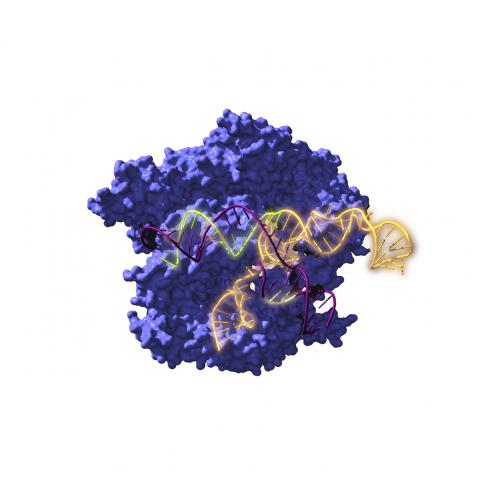
En efecto, ese artículo de Francis acabó siendo leído por dos investigadoras de forma independiente: Emmanuelle Charpentier, microbióloga francesa, y Jennifer Doudna, bioquímica estadounidense, que se sumaron a investigar los sistemas CRISPR de bacterias. Un congreso sobre esa temática las llevó a coincidir por vez primera en San Juan de Puerto Rico en marzo de 2011. Intercambiaron ideas y decidieron unir fuerzas para intentar describir uno de estos sistemas CRISPR de una bacteria particular: Streptococcus pyogenes. Apenas quince meses después, en junio de 2012, publicaban el resultado de dicha colaboración científica en la revista Science, detallando los componentes del sistema CRISPR de esa bacteria: una proteína nucleasa, llamada Cas9, que cortaba el ADN de doble cadena, y una pequeña molécula de ARN, complementaria a un determinado gen, que servía de guía e indicaba a la nucleasa dónde debía cortar en el genoma. Un sistema simple, pero tremendamente versátil y efectivo. Y cerraban su artículo sugiriendo que aquellos sistemas CRISPR bacterianos bien podrían utilizarse como herramientas para editar genes de cualquier organismo.
Las investigadoras Charpentier y Doudna unieron fuerzas para describir los sistemas CRISPR, y propusieron su uso para editar genes de cualquier organismo, una idea revolucionaria por la que ganaron el Nobel de Química
Esa idea magistral encendió la mecha de la imaginación y estimuló experimentos en laboratorios de todo el mundo. Por aquella idea revolucionaria, que puso a la biología patas arriba, Charpentier y Doudna recibieron merecidamente el Premio Nobel de Química en 2020. Sin embargo, a pesar de plantear la idea por la que fueron galardonadas, ellas no demostraron que fuera posible usar las herramientas CRISPR para editar genes. El mundo tuvo que esperar a enero de 2013, cuando dos laboratorios, de forma independiente, liderados por los investigadores Feng Zhang y George Church, publicaron sendos trabajos, también en la revista Science, ahora sí, demostrando que aquellas herramientas CRISPR servían para editar genes en células humanas. Y el resto es ya historia.
Los últimos diez años han sido una sucesión imparable de avances metodológicos, aplicaciones, mejoras y versiones cada vez más específicas y seguras de estas herramientas de edición genética. Ya tenemos animales y plantas con su genoma editado, con nuevas características biotecnológicas, aprovechables en ganadería y agricultura. Y ya tenemos los primeros pacientes que se han podido beneficiar de las CRISPR para superar enfermedades incurables hasta el momento, entre otras muchas aplicaciones que han salpicado la literatura científica reciente. Y todo ello en diez años, desde la publicación de los artículos de Zhang y Church, sin olvidar que fue hace veinte años cuando Mojica hizo la primera observación significativa que catapultó la investigación sobre los sistemas CRISPR, y sin olvidar que fue hace treinta años cuando el mismo Francis se topó, durante su tesis doctoral, por vez primera con estas secuencias. Jennifer Doudna resume estos treinta años de investigación con CRISPR en una revisión publicada en la revista Science y no se olvida de citar en los primeros lugares de su revisión el trabajo de Mojica, el que disparó la revolución CRISPR que llegó a continuación.
En 2013 se confirmó que las CRISPR eran capaces de promover la edición de genes en todos los seres vivos, pero no estaban exentos de problemas. David Liu propuso una solución a los riesgos con los editores de bases
Durante el año 2013 aparecieron una retahíla de publicaciones confirmando que las CRISPR eran capaces de promover la edición de genes en todos los seres vivos donde se probaron: plantas, animales, hongos, otras bacterias, etc. Pero también fue el año en el que descubrimos que las herramientas CRISPR no estaban exentas de problemas. En primer lugar, la molécula de ARN podía pegarse a secuencias no idénticas, pero parecidas, del genoma, propiciando el corte por la proteína Cas9 en genes distintos a los previstos, con consecuencias imprevisibles. En segundo lugar, los sistemas de reparación celulares que empezaban a actuar tras el corte del ADN por la Cas9 generaban múltiples soluciones al restañar dichas heridas en el genoma, y no todas ellas coincidían con la secuencia planeada por los investigadores. Esta incertidumbre era gestionable en los laboratorios académicos, seleccionando lo que nos interesaba y descartando todo lo demás, pero resultaba inviable en cualquier uso clínico de estas herramientas CRISPR para tratar enfermedades.
David Liu fue el investigador que propuso una solución a los riesgos y problemas de las herramientas CRISPR de primera generación al proponer una nueva versión de las mismas: los editores de bases, descritos por vez primera en 2016. Estas nuevas herramientas usaban una proteína Cas9 modificada, que solamente cortaba una de las dos cadenas del ADN, y portaban otra proteína adherida, una deaminasa, capaz de convertir, químicamente, la letra C en una T. Poco después Liu describió otros editores de bases capaces de convertir una A en una G, y una C en una G. Las sucesivas versiones de estos editores de bases, cada vez más optimizadas, han permitido llevarlos ya, en tan pocos años, a la clínica. En 2022 los primeros pacientes ya se han podido beneficiar de ellos, incluida una niña británica, Alyssa, con una leucemia muy agresiva e incurable que, sin embargo, logró superar la enfermedad gracias a estos editores de bases.
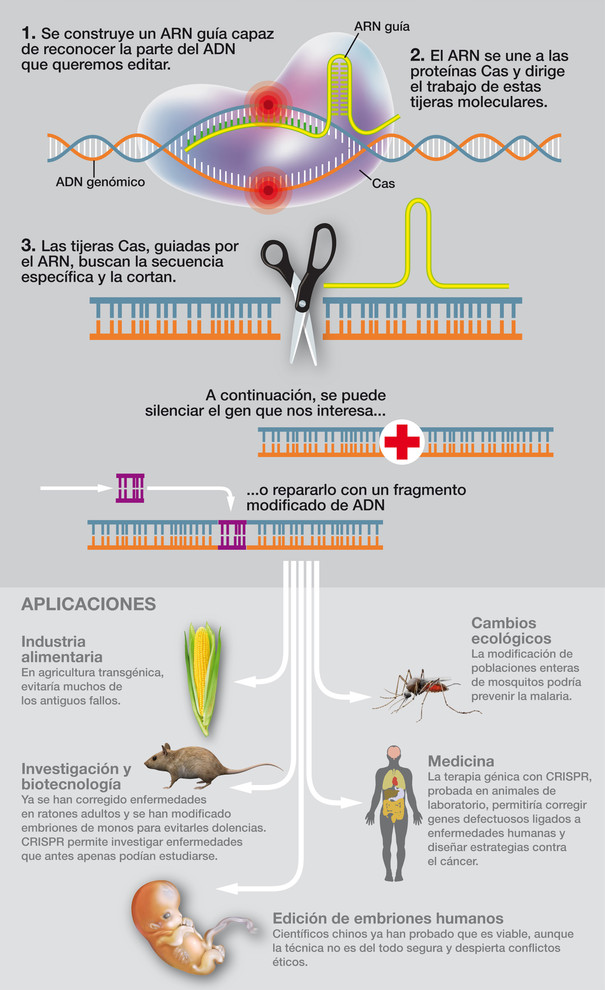
En estos diez últimos años hemos visto muchas otras aplicaciones prodigiosas de las CRISPR, como las que permiten inactivar genes causantes de enfermedades (otra forma de curar, no solo corrigiendo secuencias anómalas de los genes), o diagnosticar la presencia de virus, o incluso usarlas para atacar su genoma, o para desarrollar proyectos de investigación impensables antes de que existieran (como, por ejemplo, el análisis de la parte no codificante del genoma, habitualmente refractaria a las técnicas clásicas de ingeniería genética), o para dotar de características singulares, beneficiosas, a animales y plantas.
En diez años hemos sido testigos de aplicaciones prodigiosas de las CRISPR, como la salvación de una niña con una leucemia incurable; pero también de usos mesiánicos inadecuados, como el intento de He Jiankui de obtener una nueva estirpe de seres humanos resistentes al VIH
Pero también hemos sido testigos de usos inadecuados de las CRISPR, en manos de investigadores mesiánicos, como He Jiankui, convencidos de que podían obtener una nueva estirpe de seres humanos resistentes al VIH y, por lo tanto, incapaces de desarrollar el sida. Este desafortunado experimento, que conocimos en noviembre de 2018, produjo el nacimiento de tres niñas con su genoma alterado, trasladando imprudentemente a las pequeñas todas las incertidumbres conocidas de los sistemas CRISPR, y llevó al investigador chino a la cárcel, a pagar una fuerte multa y a quedar inhabilitado para trabajar con embriones humanos. Sin embargo, para sorpresa de propios y extraños, He salió de prisión en abril de 2022 y ya ha montado un nuevo laboratorio en Beijing donde pretende, ahora, encontrar la cura para la distrofia muscular de Duchenne, una enfermedad congénita muy grave, mortal, para la que no existe tratamiento efectivo hoy en día.
Las herramientas CRISPR han venido para quedarse. Oiremos hablar de ellas cada vez más. Se han descrito nuevas CRISPR de bacterias que viven en lugares extremos y recónditos de este planeta, o incluso hemos sido capaces de reconstruir CRISPR de bacterias que debieron existir hace miles de millones de años. Ya hay más de 70 ensayos clínicos en marcha en todo el mundo que investigan su uso potencial para tratar diferentes tipos de cáncer y de enfermedades congénitas, incluidas algunas raras. Son muchas también las variedades de plantas editadas con CRISPR que se asocian a mayores índices de producción, mejor adaptadas al medio ambiente o con características singulares. En todo el mundo, menos en la Unión Europea y Nueva Zelanda, han decidido apostar por estos cultivos. Aquí en Europa, cuna de las CRISPR, tendremos que contentarnos por el momento con adquirir los vegetales que producirán otros.
Ya hay más de 70 ensayos clínicos en marcha en todo el mundo que investigan su uso potencial para tratar diferentes tipos de cáncer y de enfermedades congénitas, incluidas algunas raras
En definitiva, es asombroso lo que hemos avanzado en diez años, sin olvidar otros veinte anteriores donde se asentaron los conocimientos básicos de los sistemas CRISPR en bacterias. Hay que recordar que nosotros nos hemos beneficiado del trabajo de optimización de estos sistemas CRISPR realizado por las bacterias durante miles de millones de años. No debería pues sorprendernos lo bien que nos funcionan estas CRISPR cuando las sacamos fuera de su contexto natural. Y por ello estoy convencido de que todavía guardan ases en la manga con los que maravillarnos.