¿Qué son los medicamentos biológicos?
Un medicamento biológico es aquel que procede de organismos o células vivas. Comenzaron a desarrollarse en los años 80 y se usan para tratar una amplia lista de enfermedades. Entre ellos se encuentran la insulina, la hormona de crecimiento, vacunas y toda una variedad de anticuerpos monoclonales empleados en el tratamiento de enfermedades autoinmunes o en muchos tipos de cáncer.
Son fármacos muy útiles, pero complejos y caros. De los veinte principios activos que suponen un mayor consumo hospitalario en España, 14 son medicamentos biológicos. En concreto, el adalimumab, que se emplea en el tratamiento de la artritis reumatoide, es el que supuso un mayor gasto en 2019, algo por encima de los 372 millones de euros, según datos del Ministerio de Sanidad. El anticuerpo eculizumab —empleado en una enfermedad rara— fue el más caro por paciente ese año, con un precio de unos 300.000 euros anuales.
¿Qué son los biosimilares?
Un biosimilar es un medicamento desarrollado para ser precisamente muy similar a otro biológico ya autorizado, al que se denomina medicamento de referencia. Ambos han de haberse mostrado equivalentes en calidad, eficacia y seguridad. Un biosimilar solo puede comercializarse una vez vencida la patente del medicamento de referencia y transcurrido su periodo de exclusividad.
¿Cuáles son las ventajas de los biosimilares y por qué se desarrollan?
Los medicamentos biológicos son complejos, el proceso hasta la aprobación es largo y suelen ser caros. Esto supone un gran coste para los sistemas sanitarios, lo que puede limitar que lleguen a todos los pacientes que los necesitan. La entrada en el mercado de fármacos biosimilares hace que entren en competencia con el medicamento de referencia y que el precio del tratamiento sea inferior.
¿Son lo mismo que los genéricos?
No, aunque el concepto resulte parecido. Los genéricos son medicamentos de síntesis química y cuya estructura suele ser sencilla, por lo que se puede garantizar que son iguales al original. Los biológicos son moléculas mucho más complejas y que se obtienen de organismos vivos, por lo que no se puede asegurar que un biosimilar sea exactamente igual a su medicamento de referencia. Sin embargo, y por el mismo motivo, esto sucede también entre lotes diferentes de un mismo medicamento biológico original.
¿Cuántos biosimilares hay aprobados y cuánto ahorro suponen?
En España hay actualmente aprobados 67 medicamentos biosimilares que corresponden a 20 principios activos. En Europa son 78 los fármacos aprobados, que engloban un total de 21 principios activos. Según un estudio encargado por la Asociación Española de Medicamentos Biosimilares (Biosim), el uso de estos medicamentos supuso un ahorro de unos 1.048 millones de euros en el año 2022 en España. Entre 2009 y 2022, el ahorro estimado fue de algo más de 5.000 millones de euros. Biosim engloba a 14 empresas que desarrollan o comercializan biosimilares, aunque algunas de ellas lo hacen también con medicamentos de referencia. Según su directora general, Encarnación Cruz, esas cifras “son conservadoras”. Además, teniendo en cuenta el número de medicamentos de referencia cuyo periodo de patente está a punto de expirar, “el mercado susceptible se va a triplicar antes de 2030”, asegura.
¿Cuánto se utilizan respecto al medicamento de referencia?
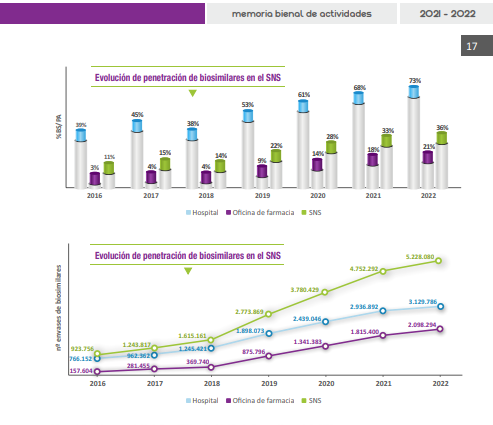
Según datos de Biosim, el porcentaje de penetración global de los medicamentos biosimilares (la proporción respecto al total de ventas de los principios activos) es del 36 %. En concreto, el porcentaje es de un 73 % en los casos de uso hospitalario y de un 21 % en farmacias. Esta disparidad puede deberse a “que hay un mayor número de medicamentos biosimilares en el ámbito hospitalario y a que llegaron antes que a las oficinas de farmacia, habiéndose generado una mayor confianza en su manejo, pero es posible que en el futuro haya un acercamiento entre ambos porcentajes”, explica Vicente Merino, Farmacéutico Especialista del Hospital Virgen Macarena de Sevilla y representante de la Sociedad Española de Farmacia Hospitalaria (SEFH).
Otro aspecto, apunta Cruz, es el de la fijación de precios: “En los hospitales suelen adquirirse mediante concurso público y los biosimilares son los que suelen presentarse a precios más bajos. En las farmacias, el precio del original y el biosimilar es el mismo por ley, alrededor de un 30 % inferior al que existía antes de la entrada del biosimilar”. Aunque el coste para todos es menor, “esta medida desincentiva el cambio a usar biosimilares y provoca un mercado cautivo”, asegura Cruz, para quien esto podría suponer un freno “al interés de las empresas por desarrollar nuevos biosimilares”.
¿Cuál es el proceso para su aprobación? ¿Qué medidas se requieren?
En Europa es la Agencia Europea de Medicamentos (EMA) quien evalúa los medicamentos biosimilares y decide su aprobación. Con su dictamen garantiza la intercambiabilidad con el fármaco de referencia [la posibilidad de usarlo en su lugar], pero la sustitución efectiva dependerá de las decisiones tomadas por cada país miembro y de la disponibilidad del producto en cada región.
La evaluación es algo diferente al de los medicamentos biológicos originales. Como en estos ya están probadas su seguridad y eficacia, las pruebas a las que se someten los biosimilares están más orientadas a garantizar que sean comparables y semejantes a los de referencia. Eso no significa que el proceso sea más laxo. Según se explica en las guías de la Comisión Europea, la autorización de los biosimilares requiere un serie de datos diferentes a la de los medicamentos biológicos de referencia, pero se aplican las mismas normas estrictas de calidad, seguridad y eficacia.
“La fase de estudios preclínicos (antes de probarse en humanos) es muy exhaustiva”, explica Merino, quien asegura que “se usa una batería muy extensa de pruebas analíticas diferentes para garantizar que sean lo más parecidos posibles y que no existan diferencias en la eficacia, seguridad e inmunogenicidad [una respuesta por parte del sistema inmunitario]”. En cuanto a la fase clínica, se realizan ensayos en fase 1 y 3, pudiendo omitir la etapa intermedia, pero cuando han superado la fase preclínica “han demostrado ser muy seguros y nunca han dado problemas, por lo que se habla incluso de prescindir de la fase 1”. En cuanto a la fase 3, “suelen incluirse más pacientes incluso que en los ensayos con el medicamento de referencia”, añade Cruz.
¿Es posible que se aprueben para indicaciones en las que no se han hecho ensayos clínicos específicos?
Sí. A ese concepto se le llama extrapolación. Si el medicamento de referencia ha probado ser útil para varias indicaciones, el biosimilar no tiene por qué demostrar su eficacia para todas ellas mediante ensayos clínicos, ya que se pueden extender los datos de seguridad y eficacia. Sin embargo, es la EMA la que decide en cada caso si son necesarios nuevos estudios para cada indicación.
Ha habido controversias respecto a la seguridad y eficacia de los biosimilares: ¿por qué? ¿Están justificadas?
“Con los biosimilares ha sucedido algo parecido a lo que ocurrió con los genéricos, que pasaron muchos años hasta confiar en que eran iguales que los originales”, asegura Encarnación Cruz. Desde las primeras aprobaciones hubo controversias sobre si eran realmente equiparables en seguridad y eficacia, con el añadido de que había una cierta variabilidad inherente a los medicamentos biológicos. Las dudas vienen a veces también, según Merino, “de la extrapolación a otras indicaciones, ya que en ocasiones no se han ensayado de forma específica en una indicación concreta”. Y a esa atmósfera “puede haber contribuido en ocasiones con ciertos mensajes la propia industria de los medicamentos de referencia”, añade.
Sin embargo, desde que en el año 2006 se aprobara el primer biosimilar en Europa, “ninguno ha dado problemas en cuanto a eficacia y seguridad más allá de los que pueda dar el biológico de referencia, y si ha habido algún inconveniente, ha sido atribuido al efecto nocebo [un resultado clínico indeseable debido a las expectativas negativas generadas por el paciente sobre el biosimilar]”, explica Merino. “Hay muchos artículos publicados sobre la ausencia de problemas por parte de los biosimilares, debido a la exigencia de los procesos de aprobación”, asegura también Cruz.
Respecto a la variabilidad, un artículo de 2010 firmado desde la Unidad de Gestión Clínica de Farmacia Hospitalaria en el Hospital de Valme de Sevilla se preguntaba por qué había nacido la controversia con la aparición de los biosimilares, cuando los medicamentos biológicos ya se intercambiaban a veces entre ellos previamente cuando uno nuevo salía al mercado. “No puede asegurarse que estos fármacos no vayan a tener nunca un problema. La posibilidad existe, pero lógicamente con una probabilidad de ocurrencia igual a la de cualquier nuevo medicamento de biotecnología que habiendo estado en el mercado varios años modifica su proceso de producción”, añadían.
¿Qué propuestas existen para aumentar su uso y desarrollo?
Estas son algunas de las iniciativas propuestas por los expertos consultados:
- Establecer mecanismos de incentivación al prescriptor mediante ganancias compartidas, de forma que el ahorro generado sirva para hacer una reinversión en el mismo centro y servicio hospitalario. Según Cruz, esta es una forma de que “se visualice que el ahorro conlleva mejoras”.
- Desde la SEFH se propone, según Merino, que en los hospitales “a igual precio se utilice el biosimilar” como forma de incentivar su uso y desarrollo. En las farmacias, Biosim propone que el medicamento original no pueda venderse con descuento durante el primer año tras la introducción del biosimilar, para evitar así un mercado cautivo.
- Establecer un objetivo de porcentaje de uso a nivel nacional, como se ha hecho en otros países de Europa.
- Aumentar su prescripción en estadíos más precoces de enfermedades como el cáncer. Según Cruz, muchas veces se reservan los medicamentos biológicos para fases más avanzadas debido a su precio. Al disminuir este con la aparición de los biosimilares, pueden ampliarse y adelantarse este tipo de tratamientos, “pero muchas veces no se está haciendo”.
- Realizar campañas institucionales de información a la población.
Aunque su despliegue es aún mejorable, Cruz no niega que ha habido una evolución positiva en la aceptación de los biosimilares, ya que “han desaparecido muchas incertidumbres, sobre todo en el ámbito hospitalario, y su uso ha crecido en los últimos años”. Merino tiene claro que “los biosimilares han llegado para quedarse, ya que van a permitir incorporar la innovación manteniendo sostenible el Sistema Público de Salud”.