¿Qué son las células CAR-T?
Se trata de un tipo de células modificadas en el laboratorio para que se dirijan hacia otro tipo de células específicas y las destruyan. En concreto, son linfocitos T —células de defensa del sistema inmunitario— que actualmente se recogen del propio paciente y a los que se le añade un gen con la información para fabricar lo que se conoce como un receptor de antígeno quimérico (CAR, por sus siglas en inglés). Este receptor reconocerá una proteína específica presente en las células que se quieran destruir y permitirá que las CAR-T las ataquen. Se trata, por tanto, de un tratamiento que combina inmunoterapia y terapia génica.
¿Para qué se usan?
Actualmente existen seis terapias comerciales aprobadas con células CAR-T. Todas ellas están indicadas para tumores de la sangre, como son el mieloma múltiple y ciertos linfomas y leucemias de linfocitos B. Sin embargo, existe mucha investigación en curso y numerosos ensayos clínicos están buscando ampliar sus indicaciones. Entre los objetivos se encuentran otros tumores sanguíneos, tumores sólidos (en órganos como pulmón, mama o colon) o enfermedades autoinmunes como el lupus o la esclerosis múltiple.
¿Qué ha pasado con la FDA y la EMA al respecto de estos tratamientos?
El 28 de noviembre de 2023, La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) emitió un comunicado informando de que había recibido informes de tumores de células T en pacientes que recibieron diversos tratamientos con células CAR-T. Según se citaba en el comunicado, “aunque los beneficios generales de estos productos siguen superando sus riesgos potenciales para sus usos aprobados, la FDA está investigando el riesgo identificado de neoplasia de células T con resultados graves, incluyendo hospitalización y muerte, y está evaluando la necesidad de una acción reguladora”. Es decir, existía la sospecha de que podían estar relacionadas con algunos cánceres.
En enero de 2024, la Agencia Europea del Medicamento (EMA) inició también una investigación al respecto.
El 14 de junio publicó los primeros resultados.
¿Qué dicen los datos hasta ahora?
Aunque la FDA no ha publicado información concreta, dos médicos que trabajan para dicha agencia escribieron un artículo al respecto en la revista NEJM. En enero de 2024, de las más de 27.000 personas tratadas con células CAR-T, se tenía constancia de 22 tumores de células T que habían sido diagnosticados tras la terapia. Según los autores, “el porcentaje global de tumores de células T entre las personas que reciben terapias CAR-T parece ser bastante bajo, incluso si se asume que todos los casos notificados están relacionados con el tratamiento”.
¿No todos están relacionados? ¿Cómo saberlo?
La terapia CAR-T es un tipo de terapia génica en la que se introduce en las células un gen externo. Aunque se trabaja para dirigirlo a lugares del genoma concretos e inofensivos, actualmente puede que, por azar, se incorpore en una región que altere la división celular, aumentando el riesgo de cáncer. También podría ser que las células T escogidas tuvieran alguna mutación previa que las predisponga. Como tras la modificación tienden a multiplicarse rápidamente, podría aumentar el riesgo. En el fondo, es difícil establecer definitivamente si la terapia ha sido la causante de un tumor, pero, para que la sospecha esté particularmente fundada, se asume que las células cancerígenas deberían tener presente el gen del receptor artificial en su genoma. No puede descartarse por completo sin su presencia, pero “hay otras razones mucho más probables para explicarlo”, asegura al SMC España Manel Juan, jefe del Servicio de Inmunología en el Hospital Clínic de Barcelona y de la Plataforma conjunta de Inmunoterapia con el Hospital Sant Joan de Déu.
“Actualmente, los pacientes que reciben este tipo de terapias están en última línea de tratamiento: ya han recibido con anterioridad muchos ciclos de quimioterapia, lo cual aumenta el riesgo de desarrollar mutaciones secundarias que no son debidas al propio CAR”, explica Juan. También está demostrado que los pacientes con tumores de células B tienen más riesgo de desarrollar neoplasias de células T per se. Y, además, es fácil que los números alojen en parte una falacia estadística: los tumores secundarios se ven en personas que han sobrevivido gracias a la terapia. Como se decía en un artículo explicativo: “En pocas palabras, uno tiene que estar vivo para que le diagnostiquen un cáncer”.
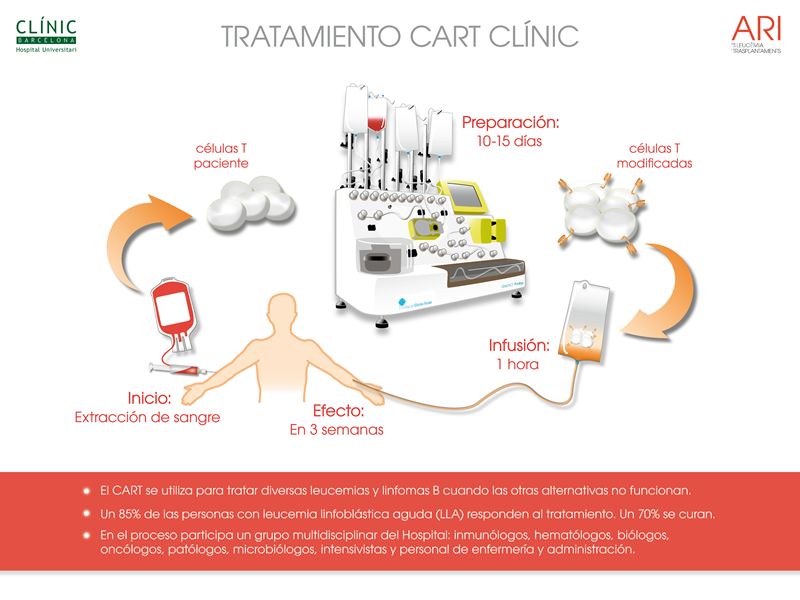
De entre los 22 casos recogidos por la FDA, y aunque muchos no han podido estudiarse con profundidad, solo se ha confirmado la presencia del gen en tres de ellos.
Los datos de la EMA, recogidos por el Comité para la Evaluación de Riesgos en Farmacovigilancia y publicados en junio, incluyen unos 42.500 pacientes tratados con este tipo de terapias. De ellos, 38 habían desarrollado un tumor de células T tras el tratamiento. La presencia del gen pudo estudiarse en la mitad de los casos y se confirmó en siete.
Además de los registros de las dos agencias, un artículo en la revista NEJM publicado también en junio incluyó a los 724 pacientes que, desde 2016, había sido tratados con terapias CAR-T en el Centro Médico de la Universidad de Stanford (Estados Unidos). De ellos, uno desarrolló un linfoma de células T sin que el gen estuviera presente. El tumor presentaba mutaciones previas y, aunque los autores no descartan un posible efecto favorecedor por la inflamación que sigue a la terapia —algo que, según Juan, “no tiene una evidencia científica clara”— y por la propia quimioterapia que la acompaña, su principal hipótesis es que: “Dado el conocido aumento del riesgo de base de segundos tumores de células T en pacientes con linfomas de células B previos [como era el caso], los tumores de células T observados después de terapias con células CAR-T, en una población de pacientes suficientemente grande, pueden reflejar un efecto circunstancial en lugar de un efecto directo”.
Más recientemente, un trabajo publicado en la revista Clinical Cancer Research ha analizado los datos de 1.253 pacientes incluidos en cuatro ensayos clínicos. Sus conclusiones son que no hay diferencias en el riesgo general de desarrollar un tumor secundario si se ha usado una terapia CAR-T en lugar de un tratamiento estándar. El riesgo, de hecho, depende fundamentalmente del número de tratamientos administrados con anterioridad.
¿Qué dicen los expertos sobre el riesgo real?
Para Ignacio Melero, catedrático de Inmunología de la Universidad de Navarra, investigador del CIMA y codirector del departamento de Inmunología e Inmunoterapia de la Clínica Universidad de Navarra, “el riesgo no está claramente cifrado, pero la estimación es que es inferior a un caso de cada mil tratamientos. Probablemente esté entre uno de cada mil y uno de cada diez mil. Es un efecto que ya temíamos que se observara cuando se analizaran series muy largas de pacientes. Para las enfermedades en que los CAR-T están indicados actualmente (leucemias, linfomas o mielomas), que son mortales a veces en el plazo de meses, el beneficio supera inmensamente al riesgo”.
Manel Juan y Joaquín Martínez López, jefe del servicio de Hematología del Hospital 12 de Octubre de Madrid, también consideran que actualmente “el beneficio es mucho mayor que el riesgo”. Además, añade Juan, “por el momento se dan en última línea de tratamiento, cuando ya han fracasado las opciones anteriores. Si en algún momento se aprueba administrarlos antes, el riesgo observado sería muy probablemente aún más bajo, pues los pacientes no habrían estado sometidos a ciclos de quimioterapia previos”.
Donde podría llegar a ser más cuestionable su uso, apunta Melero, es “si se aprobaran para otro tipo de indicaciones como enfermedades autoinmunes, sobre todo en niños. Algunas de estas enfermedades pueden ser graves e incapacitantes, pero no mortales”. Sin embargo, “el riesgo es muy bajo y posiblemente también tolerable en estas indicaciones para enfermedades no malignas”.
¿Ha cambiado algo entonces?
Tanto la FDA como la EMA continuarán revisando los datos que vayan apareciendo, como ya se ha hecho desde que comenzó el uso de estas terapias. El mensaje actual es claro, y como recoge la FDA, los beneficios para los usos actuales superan a los riesgos potenciales.
La investigación solo ha conducido hasta el momento a establecer dos cambios, que Manel Juan considera de “muy escasa importancia”:
- La FDA ha decidido añadir la información sobre el riesgo en forma de recuadro de advertencia para resaltarla en el folleto del fármaco (esta es la advertencia de seguridad más elevada que puede asignar a un medicamento). En cualquier caso, como recoge la EMA, el riesgo de desarrollar tumores secundarios ya aparecía especificado en la información de cada uno de estos productos desde su aprobación.
- Ambas agencias han decidido que los pacientes que hayan sido tratados con terapias CAR-T sean seguidos de por vida para estudiar si se desarrolla un tumor secundario. Anteriormente se exigía que el seguimiento fuera de 15 años aunque, Manel Juan, que participa en el desarrollo de tratamientos CAR-T académicos o no comerciales, recuerda: “A nosotros ya nos lo estaban exigiendo para nuestros productos”.
Para el inmunólogo, las agencias “han hecho lo que tenían que hacer, que es analizar los datos e informar de ellos”. Sin embargo, tiene la impresión de que “se ha generado un ruido y una alarma innecesaria, probablemente por la actuación de algunos medios de comunicación”.
En un artículo de análisis en la revista JAMA, la oncóloga en el Dana Farber Cancer Institute de Boston (Estados Unidos), Caron Jacobson, se mostró algo más crítica: “No tengo ningún problema con la investigación de la FDA ni con el hecho de que la haya hecho pública. Sin embargo, creo que la FDA no ha hecho un trabajo lo suficientemente bueno como para dejar claro que la mayoría de estos casos aún no se han relacionado directamente con la terapia de células CAR-T y que los pacientes con cáncer de células B corren también el riesgo de desarrollar cáncer de células T. Además, creo que fue prematuro emitir advertencias en forma de recuadro para todos los productos por la misma razón”.
Según Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA, este tipo de advertencias “no son infrecuentes en los tratamientos contra el cáncer”. Y, contestando a Jacobson, declaró: “Nadie discute que los beneficios superan con creces los riesgos, pero siempre que hay incertidumbre —y no podemos poner una medida a la incertidumbre— sentimos que es nuestro deber ayudar a informar a los médicos. Espero que esto no les haga cambiar de opinión sobre el uso de estas terapias en los casos adecuados”.