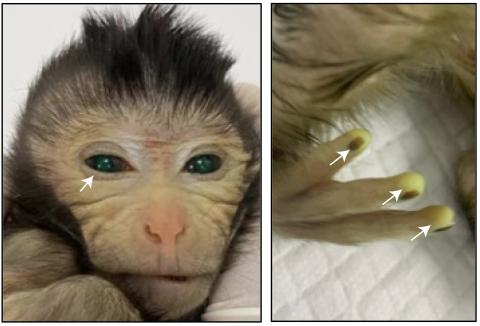
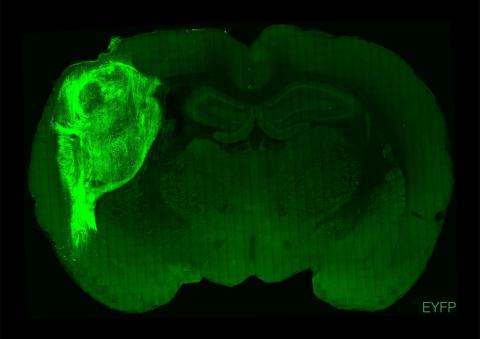
Regeneran rutas neuronales de ratones con células de ratas
Dos equipos de investigación independientes han logrado regenerar circuitos cerebrales de ratones utilizando neuronas cultivadas a partir de células madre de rata. Hoy se publicaron ambos estudios en la revista Cell. Los trabajos, en los que se generaron quimeras de distintas especies, profundizan en cómo se forma el tejido cerebral y presentan nuevas oportunidades para restaurar la función cerebral perdida debido a enfermedades y al envejecimiento.
Lluis Montoliu - quimeras ratones
Lluís Montoliu
Investigador en el Centro Nacional de Biotecnología (CNB-CSIC) y en el CIBERER-ISCIII
En octubre de 2022 el laboratorio de Sergiu Pasca, desde la Universidad de Stanford, sorprendió al mundo inyectando neuronas derivadas de organoides de cerebro humano (minicerebros simplificados en cultivo, desarrollados a partir de células troncales) en el cerebro de una rata en desarrollo, usando ratas recién nacidas atímicas (y por lo tanto incapaces de rechazar las células humanas). Aquellos cerebros quiméricos de rata, con neuronas humanas, crecieron con normalidad, a medida que el animal continuaba su desarrollo, y las células humanas se interconectaron con las neuronas de la rata hasta incluso establecer circuitos somatosensoriales funcionales. Los autores demostraron que la excitación de los bigotes de la rata activaba las neuronas humanas, confirmando que esas células estaban totalmente encajadas e intercomunicadas dentro del cerebro de la rata. Lógicamente, aquel estudió suscitó dilemas éticos, asociados a la creación de quimeras, limitadas en principio al cerebro, pero en la que se mezclaban neuronas humanas y neuronas de rata. La posible utilidad (y por ello, la justificación ética) de este experimento residía, según contaban los autores, en ser una aproximación para validar funcionalmente el estado no solo de neuronas humanas de personas sanas, sino especialmente de neuronas derivadas de pacientes con trastornos neurológicos, en los que habitualmente es muy difícil descubrir qué puede estar fallando en la función neuronal. Aquel artículo de hace menos de dos años seguramente abrió las puertas a los dos artículos que hoy conocemos, en los que dos equipos de científicos, trabajando de forma independiente, demuestran que las células troncales de rata son capaces de complementar y restituir regiones cerebrales genéticamente inhabilitadas en embriones de ratón.
En primer lugar, el laboratorio de Jun Wu, desde la Universidad de Texas Southwestern, en Dallas, reporta un sorprendente experimento en el que inactiva en embriones de ratón un gen (Hesx1, usando la tecnología CRISPR de edición genética, que es necesario para el desarrollo del cerebro anterior y, por ello, los ratones que derivarían de estos embriones carecerían de esta región cerebral frontal. Sin embargo, en el estadio de blastocisto, los investigadores inyectan células troncales pluripotentes embrionarias de rata, y estas acaban complementando el déficit neuronal y rellenan el cerebro anterior del ratón, que ahora se forma a partir de las neuronas de la rata, a partir de las células troncales inyectadas. La cabeza y el cerebro de la rata es mayor que la del ratón. Sin embargo las neuronas de rata crecen al ritmo y rellenan el espacio que les corresponde en el ratón, como si fueran neuronas de ratón, que, hasta donde pueden confirmar los investigadores, se comportan con normalidad.
El segundo experimento, desarrollado por el laboratorio de Kristin Baldwin, desde el Instituto Scripps en La Jolla y la Universidad de Columbia en New York, tiene una estructura similar. En esta ocasión los investigadores usan dos estrategias distintas para eliminar o silenciar genéticamente (mediante una estrategia de mutación condicional con el sistema Cre/loxP) las neuronas de ratón que dan lugar al bulbo olfativo, situado en la parte más anterior del cerebro. Y a esos embriones de ratón sin bulbo olfativo o con bulbo olfativo pero inactivado (y por lo tanto, anósmicos, incapaces de percibir ningún olor) les inyectan células troncales pluripotentes de rata que acaban colonizando o complementando el bulbo olfativo inexistente o no funcional del ratón con neuronas de la rata, recuperando así los ratones su capacidad olfativa. Este experimento demuestra, más allá del anterior, que la complementación no es solo estructural, rellenando o complementando las neuronas de rata el espacio o la función que deberían realizar las neuronas olfativas del ratón, sino totalmente funcional. Los ratones recuperan el olfato gracias a las neuronas olfativas de la rata. Aunque el olfato recuperado todavía no sea equivalente al de los ratones control.
Sin duda se trata de avances muy notables en neurociencias que permitirán abordar ahora muchos otros experimentos de complementación. No parece que todas las regiones del cerebro en desarrollo de una especie puedan complementarse por igual, con el mismo éxito, con las neuronas de otra especie. Sin embargo, es importante destacar que el hecho de que las conclusiones similares las obtengan dos laboratorios trabajando de forma independiente, refrenda la robustez y credibilidad de sus conclusiones y confirma la utilidad y aplicación de esta novedosa aplicación de complementación neuronal a partir de diferentes especies.
Adicionalmente, al usar ambos equipos quimeras cerebrales entre ratones y ratas los aspectos éticos asociados a estos experimentos son mucho más limitados a los que se suscitarían si se incluyeran células humanas. Creo que es un gran acierto de los dos laboratorios explorar estos experimentos de complementación usando dos especies de roedores, como la rata y el ratón, separados evolutivamente unos 20 millones de años. Las conclusiones que puedan derivarse tras esta serie de experimentos en roedores permitirán en un futuro desarrollar aplicaciones en humanos, pero ya serán abordadas con mucho más conocimiento básico de los procesos neuronales asociados a estos experimentos de complementación.
Rüdiger Behr - quimeras
Rüdiger Behr
Jefe de la Plataforma de Enfermedades Degenerativas en el Centro Alemán de Primates (DPZ), Instituto Leibniz de Investigación de Primates, Alemania.
Las publicaciones de Huang et al. y Throesch et al. tratan sobre la producción e investigación de quimeras entre ratones y ratas. Las quimeras son organismos que consisten en células que provienen de dos procesos de fertilización (embriones) diferentes. Debe hacerse una distinción entre quimeras intra e interespecíficas. En las quimeras intraespecíficas, las células quiméricas pertenecen ambas a la misma especie. Por ejemplo, las quimeras ratón-ratón se utilizan en los estudios publicados aquí. Sin embargo, en estos nuevos estudios también se producen quimeras interespecíficas entre ratón y rata. En este caso, las células que forman un organismo provienen de dos especies diferentes. Las quimeras interespecíficas son de particular interés desde una perspectiva de biología del desarrollo y evolutiva. Sin embargo, las quimeras interespecíficas también pueden proporcionar ideas muy valiosas sobre la producción de órganos trasplantables para la medicina humana. Este es un objetivo de investigación prioritario dada la escasez de órganos donantes para trasplantes en pacientes que lleva décadas.
Las quimeras deben distinguirse claramente de los híbridos. A diferencia de las quimeras, los híbridos se desarrollan a partir de una sola célula huevo fertilizada. Sin embargo, en los híbridos, el esperma masculino y el óvulo femenino provienen de dos especies diferentes (pero estrechamente relacionadas). Por ejemplo, el esperma de un burro puede fertilizar con éxito el óvulo de un caballo. El embrión resultante se desarrolla en una mula. En un híbrido, todas las células individuales del organismo mismo son ya una ‘mezcla' de las dos especies parentales. En una quimera interespecífica, por otro lado, cada célula individual está claramente asignada a una especie.
En los dos estudios actuales, las quimeras se generan experimentalmente en la etapa de blastocisto. Alrededor de diez células madre 'todoterreno’ se inyectan en un embrión que tiene unos pocos días de edad y alrededor de una décima parte de un milímetro de tamaño, que en esta etapa es una pequeña burbuja de células llena de líquido. Las células madre inyectadas se integran en el embrión receptor y se codesarrollan con él más o menos eficientemente hasta el nacimiento. La integración de las células madre inyectadas es mucho más eficiente si el embrión receptor no puede formar tejidos u órganos individuales debido a una modificación genética específica. Estos nichos anatómicos libres en desarrollo embrionario son entonces ocupados y llenados de manera particularmente eficiente por las células quiméricas inyectadas. Este proceso se conoce como complementación de blastocistos.
Huang et al. merecen crédito por acelerar significativamente el proceso de complementación de blastocistos al combinar los métodos genéticos para abrir un nicho en el cual las células quiméricas pueden implantarse eficientemente con los métodos de complementación de blastocistos previos en un paso. Esta nueva tecnología combinada acelerará enormemente la investigación de quimeras, especialmente en mamíferos más grandes con un tiempo de generación más largo. Dado que algunos de los autores de este estudio trabajan en un centro de primates chino, se puede suponer que esta tecnología ahora también se utilizará en primates no humanos.
Throesch et al. pudieron demostrar por primera vez que las células quiméricas podrían compensar la pérdida de células nerviosas embrionarias no solo estructuralmente sino también funcionalmente. Así, los ratones quiméricos pudieron encontrar alimentos ocultos de manera más dirigida utilizando un sentido del olfato restaurado por células de rata. El comportamiento complejo de un ratón fue desencadenado por el sentido del olfato de una rata. El ratón olía la comida con el olfato de una rata, por así decirlo.
La investigación de quimeras ayuda a generar conocimiento para hacer que las terapias de reemplazo celular y tisular estén disponibles para los pacientes más rápidamente. Sin embargo, el enfoque de creación de quimeras presentado aquí no es un enfoque que se pueda transferir directamente a humanos como terapia. El trabajo presentado aquí es muy valioso para una mejor comprensión del desarrollo embrionario de los cerebros, sus adaptaciones evolutivas y cómo funcionan.
La investigación bioética acompañante es necesaria, a más tardar, cuando los embriones humanos se utilicen como receptores en la investigación de quimeras. Personalmente, rechazaría estrictamente el uso de embriones humanos en la investigación de quimeras interespecíficas, incluso si esto estuviera permitido en Alemania. Pero incluso si se trasplantan células madre humanas en embriones animales, lo que puede tener sentido desde un punto de vista biomédico, debería tener lugar un discurso biomédico-bioético.
La investigación de quimeras modernas todavía está en pañales. Actualmente, se pueden obtener importantes hallazgos fundamentales prácticamente de cada estudio de quimeras, que en su conjunto promueven en gran medida el concepto de cultivar órganos de reemplazo a partir de células humanas para trasplantes de órganos, por ejemplo, en cerdos.
En mi opinión, los dos estudios que se han publicado ahora aún no proporcionan un enfoque traslacional para nuevos enfoques terapéuticos. Sin embargo, contribuyen significativamente al conocimiento científico sobre el cual se pueden construir nuevas terapias a largo plazo.
Stefan Schlatt - quimeras
Stefan Schlatt
Director del Centro de Medicina Reproductiva y Andrología, Hospital Universitario de Münster (UKM), Alemania
No hay motivo de preocupación, pero sí motivo de asombro. Sabemos desde hace muchos años que las células inyectadas en blastocistos pueden reparar un organismo. Ahora esto ha sido confirmado por defectos orgánicos producidos experimentalmente. No es sorprendente que esto también se aplique al cerebro. Sin embargo, es bastante sorprendente que las células neuronales sean extremadamente plásticas y apoyen la organogénesis a través de los límites de las especies, incluido el cerebro. Aquí necesitamos revisar nuestra comprensión de la genética y los límites de las especies a favor de una mayor importancia de la plasticidad celular en la formación de órganos.
Las quimeras nos permiten estudiar la interacción de diferentes células a través de marcadores. Esto es extremadamente útil para describir los procesos de desarrollo en la formación de órganos. En estos estudios xenológicos sobre el cerebro, queda claro que las células neuronales también pueden corresponderse entre sí a través de los límites de las especies y formar redes funcionales. El hecho de que adapten su programa de reparación según las condiciones (células enfermas pero presentes, células eliminadas) era desconocido anteriormente. En este sentido, estos estudios proporcionarán hallazgos importantes para enfoques terapéuticos. Si solo se utilizarán los hallazgos o incluso las células para este fin, no se puede estimar en la actualidad.
En principio, tales experimentos también son posibles entre otras especies. Sin embargo, ya sabemos por otros sistemas de órganos que los procesos regenerativos no son intercambiables arbitrariamente. Por ejemplo, las células madre testiculares de las ratas pueden generar esperma en los testículos de los ratones, pero las células madre de primates no pueden. Aunque se instalan, no se diferencian y permanecen como células madre en el testículo del ratón. Será emocionante estudiar los diferentes sistemas de órganos y aprender qué procesos están más conservados y permiten la comunicación e interacción entre especies.
Por razones éticas, parece que aquí se requiere precaución. Si bien la complementación de blastocistos abre un campo muy interesante para la investigación básica, la generación de reemplazos de órganos para aplicaciones clínicas no es un escenario realista. Todavía parece haber muy poco conocimiento sobre los efectos específicos de especies y órganos para poder evaluar los riesgos. Al igual que con la clonación, aquí debería haber una moratoria reconocida internacionalmente.
- Artículo de investigación
- Revisado por pares
- Animales
Throesch et al.
- Artículo de investigación
- Revisado por pares
- Animales
- Artículo de investigación
- Revisado por pares
- Animales
Huan et al.
- Artículo de investigación
- Revisado por pares
- Animales