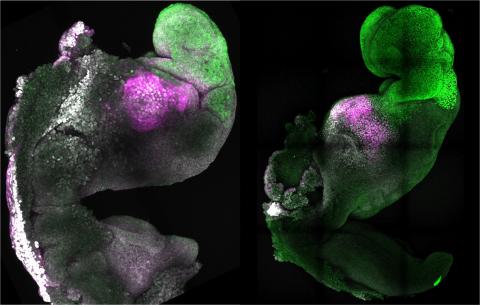
Reacciones: desarrollan e implantan en el útero estructuras similares a embriones de macaco a partir de células madre
Un grupo de investigadores chinos ha logrado desarrollar estructuras similares a embriones de macaco a partir de células madre embrionarias. Además, han conseguido que se implanten en el útero de hembras de macaco y que se desarrolle una respuesta hormonal similar a la de una gestación, aunque solo han sobrevivido alrededor de una semana. Según los autores, cuya investigación se publica en Cell Stem Cell, estos modelos podrían servir para mejorar el conocimiento sobre el desarrollo embrionario y para investigar las causas de algunos abortos tempranos.

Hembra de macaco y su cría en el Parque Forestal de Djuanda, Java Occidental (Indonesia). Autor: Rossche-Wikipedia.
Alfonso - Macacos
Alfonso Martínez Arias
Profesor de investigación ICREA Senior e investigador en Sistemas de Bioingeniería-MELIS de la Universidad Pompeu Fabra
El estudio es un paso en la caracterización de modelos del desarrollo embrionario basados en células madre embrionarias. Este trabajo está basado en los estudios pioneros de Nicolas Rivron, que fue el primero en construir blastocistos con células madre. El blastocisto es el primer hito en el desarrollo de un mamífero y, por supuesto, de un ser humano. Rivron fue capaz de construir estructuras similares a blastocistos de ratón y humano que llamó ‘blastoides’.
Desde el punto de vista estructural (genes que expresan sus células), los blastoides son casi idénticos a sus homólogos naturales, los blastocistos. Sin embargo, la prueba de lo que son es funcional. Lo que hace el blastocisto es implantarse en el útero y, una vez bien asentado, comenzar la construcción del organismo con el proceso de gastrulación: la generación de las semillas de cada tejido y órgano a la vez que se ordenan en el espacio. Hasta ahora no había evidencia de que los blastoides pudieran implantarse correctamente e iniciar el desarrollo del embrión. En el caso de los humanos, por razones éticas obvias.
En este trabajo, un grupo de investigadores chinos presenta datos de blastoides de macacos que parecen implantar y que, dicen, inician la gastrulación en el vientre maternal. Los datos parecen de buena calidad, y aunque la frecuencia de éxito es baja, la demostración de que estos blastoides implantan parece segura. Menos claro es si gastrulan. Mi impresión es que el proceso de gastrulación es defectuoso. Los pocos embriones que inician esta fase crucial del desarrollo colapsan al poco de iniciar el proceso.
El trabajo es un paso más en la caracterización de estos modelos de desarrollo basados en células madre embrionarias y habrá otros. Su valor dependerá de dos cosas: la reproducibilidad y la demostración de su valor científico en aportar conocimiento nuevo. Lo último está, por el momento, lejos. Los macacos y los humanos son diferentes, incluso en la manera en la que los blastocistos implantan. Veo este trabajo como una prueba de concepto que será un reto reproducir por el coste de la investigación —trabajar con primates no es fácil ni asequible—, pero claramente es una evidencia de que los blastoides serán, son, una herramienta útil para estudiar los primeros pasos de la implantación uterina, que afectan a muchos aspectos de la infertilidad.
Montoliu- Macacos
Lluís Montoliu
Investigador en el Centro Nacional de Biotecnología (CNB-CSIC) y en el CIBERER-ISCIII
Las células troncales pluripotentes embrionarias humanas (hESC) fueron aisladas de blastocistos por vez primera en 1998 por el equipo de J. Thompson. Sin embargo, ese gran avance llegó 17 años después de que se hubieran aislado las mismas células de blastocistos de ratón (mESC) por Martin Evans y Gail Martin, de forma independiente. La biología de las células mESC, pioneras, tomó la delantera y se ha desarrollado mucho más que la correspondiente a las hESC.
Con las células mESC es posible regenerar un ratón completo, reintroduciéndolas en otro blastocisto o agregándolas con embriones preimplantatorios de fases anteriores. Y esto ha servido para generar los miles de ratones mutantes existentes en la actualidad, muchos de ellos modelos animales de enfermedades humanas. También pueden usarse las mESC para derivar cualquier otro tipo celular in vitro, en el laboratorio. E incluso se ha reportado la aparición espontánea, aunque muy poco eficiente, de embriones sintéticos de ratón en el laboratorio mezclando estas mESC con otros tipos de células troncales.
Toda esa sorprendente versatilidad y maleabilidad que muestran las mESC no es posible replicarla con las células hESC, por diversas razones, científicas, legales y éticas. Por ejemplo, está prohibido en la mayoría de países, como España, cultivar embriones humanos más allá de 14 días.
Por todo ello, los investigadores de este estudio ahora publicado en la revista Cell Stem Cell, han optado por trasladar las nuevas técnicas de cultivo y agregación desarrolladas en las células mESC de ratón a las cyESC, que son células troncales pluripotentes embrionarias de macaco (Cynomolgus), un primate no humano, evolutivamente relacionado con nosotros, como una aproximación intermedia al experimento con hESC, actualmente irrealizable. Y, efectivamente, logran obtener un blastoide de macaco (parecido pero no idéntico al blastocisto) a partir de cyESC y, usando estos blastoides, logran diferenciar diferentes tipos celulares en el laboratorio, logran obtener embrioides con las tres capas germinales y, tras implantarlos en el útero de hembras de macaco, han conseguido evidencias de gestación.
El estudio no reporta el nacimiento de ningún bebé macaco por el momento. Este es un experimento que no puede realizarse en humanos, por las limitaciones técnicas, legales y éticas asociadas, pero estudios como este, realizado en macacos, nos acercan paulatinamente a dicha posibilidad. Cada vez está más cerca el nacimiento de primates no humanos derivados íntegramente de células troncales pluripotentes embrionarias cultivadas en el laboratorio (el siguiente trabajo que intentarán sin duda llevar a cabo los autores de este estudio), sin necesidad de pasar por la fecundación de un óvulo por un espermatozoide, como ya es posible, desde hace años, en ratones.
Queda por ver cuántos de estos avances llegarán a ser testados en células troncales pluripotentes embrionarias humanas. Y quizás sería lícito también preguntarnos si deberíamos acometer estos experimentos, cómo deberíamos regularlos y con qué fines deberíamos permitir abordarlos.
Urries - Macacos
Antonio Urries
Director de la Unidad de Reproducción Asistida del Hospital Quirónsalud de Zaragoza y miembro del Comité Científico Quirónsalud
Lo primero que hay que tener muy en cuenta respecto al artículo es que lo que han generado no son embriones propiamente dichos, sino estructuras “embrioides” capaces de comportarse como un embrión en sus primeros días de desarrollo.
En este trabajo, el equipo de Li logra generar blastoides a partir de células madre embrionarias de mono, con unas características similares a los blastocistos naturales, consiguiendo mantener su desarrollo a largo plazo e incluso su implantación en el útero de madres de macaco subrogadas y generando embarazos con presencia de sacos gestacionales tempranos.
Si bien es cierto que ya se han conseguido generar con éxito este tipo de estructuras embrioides en humanos con morfología y estructuras similares a los embriones naturales, no está permitido su cultivo más allá del día 14 ni su implantación en el útero de una mujer debido a cuestiones éticas. Por ello, poder hacer este tipo de investigaciones en una especie tan estrechamente relacionada con la nuestra como los monos macacos supone un modelo ideal para el estudio en detalle de las primeras fases de desarrollo de órganos tan vitales de los mamíferos como son el corazón, cerebro o tubo neural. El comienzo de la organogénesis.
Por otra parte, nos puede ayudar a profundizar en determinados mecanismos de implantación y comprender por qué fallan los embarazos, detectando aquellas anomalías que pueden generar abortos. Igualmente, nos puede guiar en el desarrollo de órganos y tejidos “sintéticos” para trasplantes y conocer el origen de algunas enfermedades.
Naturalmente, tiene las limitaciones propias de ser una técnica en fase muy preliminar, fruto de un proceso muy complicado e ineficiente (alrededor del 25 %), pero con un gran potencial a futuro y una aplicabilidad en humanos muy esperanzadora.
- Artículo de investigación
- Revisado por pares
- Estudio experimental
- Animales
Li et al.
- Artículo de investigación
- Revisado por pares
- Estudio experimental
- Animales