Reacciones a la generación de embriones sintéticos de ratón derivados de células madre
Una investigación publicada en Nature muestra la creación de embriones sintéticos de ratón derivados de células madre. El modelo de embrión copia las etapas del desarrollo del embrión natural del roedor que tienen lugar hasta el día 8,5 después de la fecundación e incluye regiones del cerebro, un tubo neural y una estructura similar a un corazón que late.
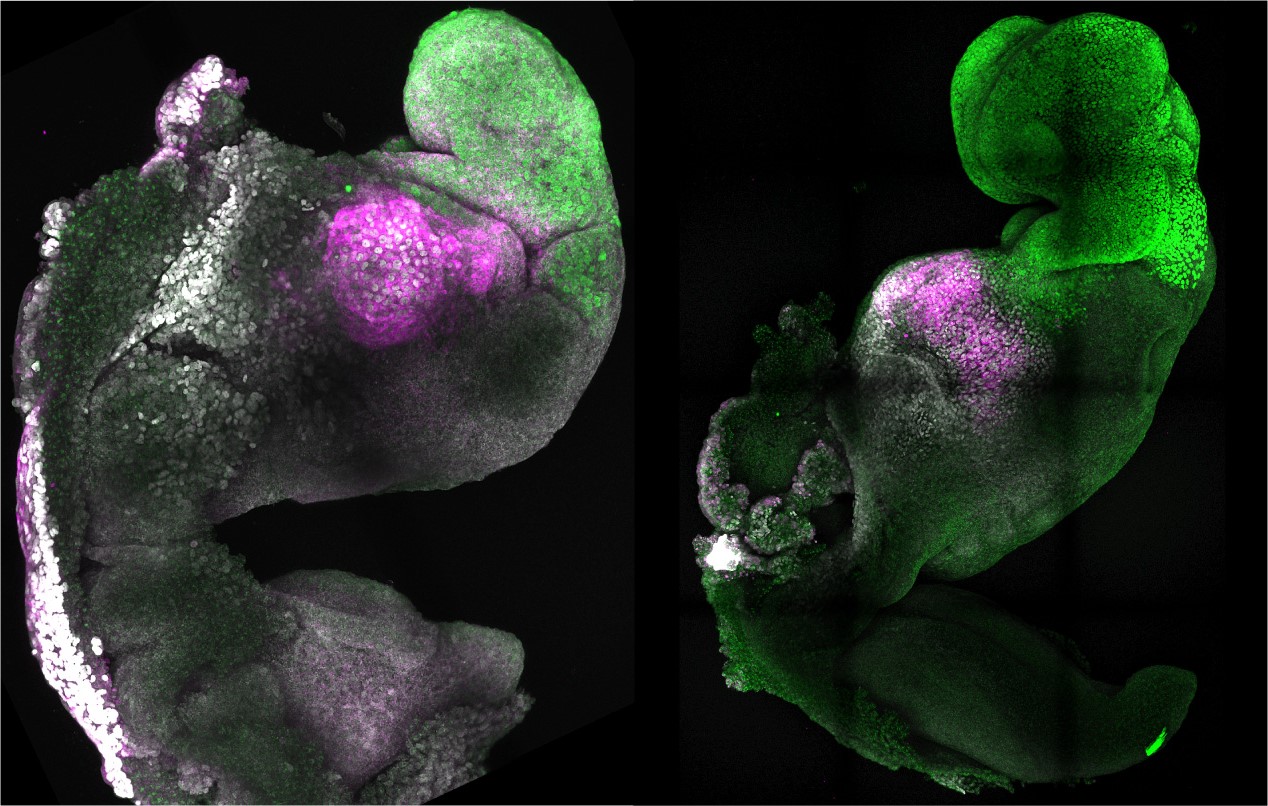
Los embriones naturales y sintéticos muestran, uno al lado del otro, formaciones comparables de cerebro y corazón. Autor: Amadei y Handford.
Alfonso Martínez - embrión ratón
Alfonso Martínez Arias
Profesor de investigación ICREA Senior e investigador en Sistemas de Bioingeniería-MELIS de la Universidad Pompeu Fabra
Este trabajo es una adición importante al publicado por el grupo de Jacob Hanna en Cell hace unos días. Los dos representan un avance importante, pues prueban la necesidad de interacción entre células embrionarias y extraembrionarias en la formación de un mamífero. Más aún, demuestran que es posible iniciar el desarrollo de un mamífero fuera del útero. Pero es más una ‘prueba de concepto’ que un logro absoluto. Como en el caso del trabajo de Hanna, el número de embriones sintéticos que se obtienen con el método es pequeño (del orden de 1 % de los cultivos iniciales) y su desarrollo colapsa prematuramente después de pocos días en cultivo. También es importante constatar que las estructuras obtenidas, aunque contienen los elementos de un embrión, tienen carencias importantes y la mayor parte de esas estructuras están dañadas o incompletas. Tampoco está claro qué, exactamente, es lo que se quiere obtener de estas estructuras que, uno tiene la impresión, surgen del cultivo casi por arte de magia.
La necesidad de hacer hincapié en los defectos y el bajo rendimiento del experimento es importante, pues la idea de que se ha obtenido un embrión de ratón en el cultivo dará lugar a la noción de que pronto se hará lo mismo con células humanas y que se conseguirá un embrión humano. Es muy probable que esto ocurra en el futuro y un valor que tiene este experimento es alertarnos ante esta posibilidad para que consideremos los aspectos éticos de estos experimentos y el impacto social que pueden tener.
Desde luego, los dos trabajos son importantes, pero están en unos estadios muy tempranos y habrá que esperar a ver cómo se desarrollan. Mucho más importante será ver qué aplicaciones tiene el sistema. Para dar ese paso, la eficiencia y la precisión tendrán que aumentar. Por el momento, las hembras de ratón hacen embriones perfectos con más eficiencia.
“Mi grupo ha desarrollado un sistema alternativo para estudiar el desarrollo de mamíferos a partir de células madre (gastruloides), pero no es un sistema que compita con este”.
Lluís Montoliu - embriones ratones
Lluís Montoliu
Investigador en el Centro Nacional de Biotecnología (CNB-CSIC) y en el CIBERER-ISCIII
El reto fundamental en biología sigue siendo llegar a comprender cómo se desarrolla un organismo vivo y tan complejo como cualquiera de nosotros a partir de una sola célula. Entender cómo van apareciendo a lo largo del desarrollo embrionario centenares de tipos celulares diferentes a partir de un solo embrión unicelular, que es el producto de la fecundación de un óvulo por un espermatozoide. Para responder a estas preguntas podemos asistir como testigos al desarrollo de otros animales, como el pez cebra, cuyos embriones se desarrollan externamente, dentro de huevos transparentes que permiten ver todo lo que ocurre en su interior. Sin embargo, para mamíferos, como nosotros, es mucho más difícil, dado que el embrión se implanta en el útero de las hembras y se desarrolla dentro de estructuras anatómicas difícilmente visibles y accesibles. Nuestra capacidad para observar en detalle, directamente, lo que ocurre durante el desarrollo de un embrión de mamífero se limita a las etapas iniciales, previas a la implantación del embrión en el útero.
Este es el reto que se planteó el laboratorio de Magdalena Zernicka-Goetz y cuyos resultados ahora expone en su artículo publicado en la revista Nature. Ella ha conseguido reproducir las fases iniciales del desarrollo de un embrión de mamífero, de un ratón, en el laboratorio, sin necesitar la participación de una hembra a la que implantar ese embrión. Y también lo ha conseguido sin necesidad de recurrir a la fecundación de un óvulo por un espermatozoide. En su lugar, estos investigadores han usado diferentes tipos de células troncales embrionarias (células madre) las cuales, mezcladas oportunamente, dan lugar a una nueva estructura biológica que se parece mucho a un embrión natural, sin serlo. Son los embriones sintéticos, desarrollados íntegramente en el laboratorio.
Para el desarrollo extrauterino de estos embriones sintéticos el laboratorio de Zernicka en Caltech (California, Estados Unidos) ha usado un dispositivo, un incubador artificial que permite simular las condiciones fisiológicas que existen en el útero de la hembra. Esta ingeniosa solución técnica la desarrolló el laboratorio de Jacob Hanna, del Instituto Weizmann en Israel, coautor de este estudio y quien también ha reportado experimentos similares hace unas pocas semanas, publicados en la revista Cell.
Los embriones sintéticos consiguen llegar a una fase equivalente a la que llegarían los embriones naturales con 8-9 días de gestación, casi la mitad del tiempo de embarazo en los ratones, que es de 19-20 días. Y consiguen desarrollar estructuras anatómicas muy similares, como por ejemplo el corazón, con su latido, y el cerebro, con sus diferentes áreas. Estos embriones sintéticos no son embriones, pero sirven para investigarlos.
Dado que estos embriones sintéticos derivan de células embrionarias troncales en cultivo, pueden generarse también a partir de células que contengan alguna mutación en algún gen, y así investigar el efecto que esa mutación produce en las fases iniciales del desarrollo, observando directamente en el laboratorio qué ocurre en cada momento. Un privilegio que los investigadores antes no teníamos con los embriones de mamífero.
Sin duda estamos ante una nueva revolución tecnológica, todavía muy ineficiente (es muy difícil conseguir que las células madre generen espontáneamente un embrión sintético), pero con un enorme potencial. Recuerda a avances científicos tan espectaculares como el nacimiento de la oveja Dolly, que conocimos en 1997, reconstruyendo un embrión con el núcleo de una célula somática, o las células embrionarias pluripotentes inducibles, las iPS, descritas por Yamanaka en 2006, que lo llevaron a obtener el Premio Nobel de Fisiología o Medicina en 2012, compartido con John Gurdon, pionero de la clonación animal en anfibios. Una revolución que naturalmente también suscita nuevos dilemas éticos, si alguna vez pensamos trasladar estos experimentos a la especie humana para la generación de embriones sintéticos humanos, quizás con el fin de usarlos para obtener nuevos tejidos u órganos para reparar o substituir los que estén dañados, como ya se ha propuesto explorar Hanna, a través de una empresa creada por él ad hoc.
- Artículo de investigación
- Revisado por pares
- Animales
Ginaluca Amadel et al.
- Artículo de investigación
- Revisado por pares
- Animales